Nhân giống in Vitro loài húng quế tây Ocimum basilicum L
Nhân giống Húng quế tây bằng phương pháp nuôi cấy mô thực vật.Từ khóa: Ocimum basilicum, nuôi cấy mô, vi nhân giống, húng quế, chất điều hòa sinh trưởng

TÓM TẮT
Húng quế tây hay húng quế ngọt Ocimum basilicum L. thuộc họ Lamiaceae, giàu tinh dầu thơm và có giá trị trong dược phẩm, ẩm thực và hương liệu. Nghiên cứu này mô tả quy trình vi nhân giống loài O. basilicum sử dụng lá mầm từ cây được cho nảy mầm in vitro. Lá mầm từ hạt đã nảy mầm in vitro được sử dụng làm mẫu vật ban đầu, nuôi trong môi trường MS (Murashige và Skoog, 1962) với 0.2 mg.L-1 NAA (1-Naphthalene acetic acid) kết hợp với 0 – 5 mg.L-1 BAP (6-Benzyl aminopurine), và nuôi ở nhiệt độ 28 ± 1oC, chu kì sáng 16 giờ, cường độ sáng 48 µmol.m-2.s-1 , trong 45 ngày. Sự hình thành chồi hiệu quả nhất sau 45 ngày nuôi cấy xảy ra trong môi trường chứa 5 mg.L-1 BAP và 0.2 mg.L–1 NAA. Sự hiện diện của NAA ức chế sự hình thành rễ khi kết hợp chất này với các nồng độ khác nhau của cytokinin (BAP, từ 1 đến 5 mg.L-1). Nồng độ BAP cao hơn sẽ kích thích và gia tăng số lượng mẫu vật tạo chồi và tăng số lượng chồi trên mỗi mẫu vật lá mầm.

Giới thiệu
Húng quế tây hay húng ngọt Ocimum basilicum L. thuộc họ Lamiaceae là một loài thảo mộc giàu các tinh dầu thiên nhiên và có giá trị trong dược phẩm, hương liệu và ẩm thực. Loài cây này kích thích tiêu hóa, tẩy giun sán, hạ sốt, làm toát mồ hôi, long đờm, kích thích trung tiện, là chất kích thích và dùng chữa bệnh đau ngực (Sahoo và cộng sự, 1997; Phippen và Simon, 1998). Rễ, vỏ cây và lá có chứa các cyanogen. Hạt có tính làm dịu chỗ viêm, kích thích, lợi tiểu và làm toát mồ hôi (Sahoo và cộng sự, 1997). Các loại húng quế thương mại hiện nay đa dạng về hình dạng lá, kết cấu lá, màu sắc, màu hoa, chiều cao, hình dạng cây và hương vị. Húng quế tím là cây giàu anthocyanin và chứa nhiều hợp chất chống oxy hóa (Phippen và Simon, 1998). Tuy nhiên, khó khăn chính trong sử dụng các loài trong họ Lamiaceae cho mục đích dược phẩm là sự khác biệt cá thể do di truyền và sinh hóa không đồng nhất (Shetty, 1997; Vieira và cộng sự, 2001).
Nhân giống in vitro là biện pháp hiệu quả để nhân nhanh số lượng loài, để có được cây con có tính đồng nhất cao. Vì vậy việc sử dụng những kỹ thuật này để nhân giống nhanh các cây hương liệu và dược liệu ở quy mô lớn gia tăng đáng kể trong những năm gần đây (Sahoo và cộng sự, 1997). Đã có nhiều nghiên cứu được tiến hành ở họ Lamiaceae, bao gồm cả chi Ocimun, sử dụng các mẫu vật khác nhau như phần đốt (Ahuja và cộng sự, 1982; Shahzad và Siddiqui, 2000; Begun và cộng sự, 2000), phần lá (Phippen và Simon, 2000), phát hoa còn non (Singh và Sehgal, 1999) và chồi bên (Singh và Sehgal, 1999). Trong nghiên cứu này mô tả quy trình vi nhân giống O. basilicum sử dụng lá mầm từ hạt nảy mầm in vitro.
Vật liệu và phương pháp
Hạt từ loài O. basilicum được khử trùng bề mặt bằng cồn 70% khoảng 2 phút và rửa sạch 3 lần với nước cất vô trùng, tiếp theo khử trùng bằng dung dịch sodium hypochlorite và rửa lại 3 lần với nước cất vô trùng. Hạt đã được vô trùng bề mặt được cấy vào môi trường MS, môi trường nuôi cho nảy mầm, bổ sung 3% sucrose, 100 mg.L-1 myo-inositol, 0.7% agar và pH 5.8, cho 6 hạt trong mỗi bình nuôi cấy và sử dụng 35 bình.
Sau 12 ngày nuôi cấy ban đầu, lấy lá mầm cắt ra và sử dụng cho nuôi cấy về sau. Môi trường MS (1962) bổ sung sucrose (3% w/v), myo-inositol (100mg.L-1 w/v) và kết hợp các hormone khác nhau. pH của môi trường được chỉnh về 5.8 trước khi làm đông bằng agar (0.7% w/v), cho 30 mL môi trường vào bình nuôi cấy 150 mL, hấp khử trùng ở áp suất 1.5 atm, 121°C khoảng 20 phút.
Nuôi cấy trong điều kiện nhiệt độ 28 ± 1°C, chu kì sáng 16 giờ đèn có ánh sáng lạnh (48 µmol.m-2.s-1), khoảng 45 ngày. Thí nghiệm được thiết kế ngẫu nhiên, mỗi nghiệm thức là sự kết hợp giữa BAP (0,1, 2, 3, 4 và 5mg.L-1) với 0.2 mg/L NAA. Mỗi nghiệm thức lặp lại 6 lần, sử dụng 5 lá mầm cho mỗi độ lặp. Dữ liệu được ghi nhận để phân tích và so sánh thống kê bằng Duncan test hoặc phân tích hồi quy đa thức, bằng chương trình thống kê SANEST-Sistema de Analise estatística (Zonta và Machado,1984). Dữ liệu được thể hiện dưới dạng phần trăm được chuyển sang arcsin của căn bậc hai, dữ liệu trung bình số chồi trên mỗi mẫu vật được chuyển sang dạng căn bậc hai của (x+0.5). Những chồi mới (dài 1.5 cm) được chuyển sang môi trường ½ MS không có chất điều hòa sinh trưởng. Sau 45 ngày, chồi ra rễ thì đem trồng ra đất.
Kết quả và thảo luận
Lá mầm là nguồn mẫu vật thích hợp cho vi nhân giống chi Ocimum. Chồi bất định, mô sẹo và rễ hình thành phụ thuộc vào sự cân bằng các hormone trong môi trường nuôi cấy. Khi nồng độ auxin thấp (0.2 mg/L NAA) kết hợp với các nòng độ khác nhau của cytokinin (BAP) có hiệu quả khởi phát mô sẹo (Hình 1). Tế bào của chồi mới trong các môi trường có sự kết hợp hormone có những biểu hiện rất khác nhau trên các môi trường. Sự khác biệt này là do nồng độ của cytokinin.
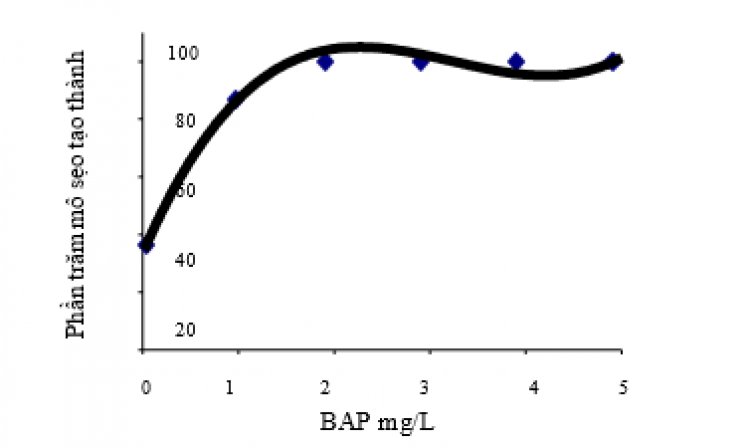
Hình 1. Phần trăm mô sẹo được tạo thành từ mẫu vật lá mầm trong các môi trường có nồng độ BAP khác nhau.
Các mô đặc, có màu xanh và có phát sinh cơ quan hình thành trên môi trường có nồng độ cao BAP, trong khi đó các mô bở rời, màu kem xuất hiện trên môi trường có nồng độ BAP thấp. Lá mầm dược nuôi cấy trên môi trường chứa 0.2 mg/L NAA và 5 mg/L BAP sau khoảng 45 ngày cho hiệu quả tạo chồi trên mỗi mẫu vật cao nhất (66.7%) và cho số lượng chồi nhiều (3.46), thể hiện ở hình 2 và 3.
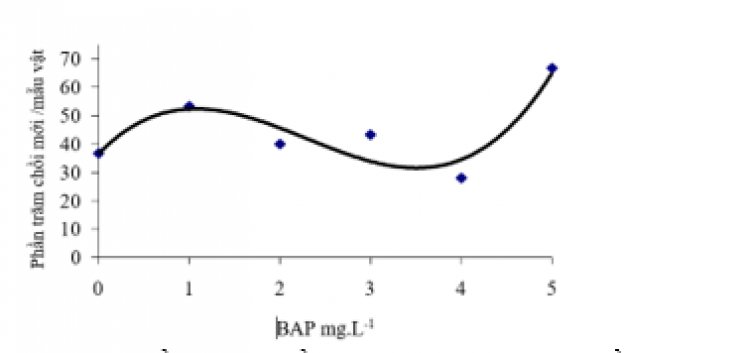
Hình 2. Phần trăm chồi mới phát sinh từ lá mầm húng quế ở các nồng độ BAP khác nhau.
Nhân giống in vitro loài Ocimum basilicum L.
Môi trường có phản ứng tốt thứ hai có chứa 1 mg/L BAP và 0.2 mg/L NAA. Singh và Seghal (1999) đã quan sát thấy nhiều chồi mới của O. sanctun sinh ra trực tiếp trên môi trường MS có chứa 0.5 – 3 mg/L BAP. Trong nghiên cứu của họ, môi trường chứa 1 mg/L BAP và 0.05 NAA cho hiệu quả tốt nhất.

Hình 3. Số lượng chồi trung bình trên mỗi mẫu vật trong môi trường có nồng độ BAP khác nhau
Theo một vài tác giả, có mối liên hệ chặt chẽ giữa tỉ lệ auxin/cytokinin trong môi trường nuôi cấy với sự phát sinh chồi từ những bộ phận mẫu vật và kiểu gen khác nhau (Pattnaik và Chand, 1996; Khanna và Raina, 1998; Singh và Sehgal, 1999; Shahzad và Siddiqui, 2000).
Phippen và Simon (2000) sử dụng cytokinin ở nồng độ cao để kích thích thành công sự phát sinh cơ quan từ lá đối với cây húng quế. Tuy nhiên môi trường sử dụng lại không phù hợp để tạo chồi từ lá mầm, cuống lá hoặc thân.
Trong nghiên cứu này, sự hiện diện của NAA (auxin) đã ức chế sự tạo rễ mặc dù đã có sự kết hợp với các nồng độ khác nhau của cytokinin. Sự cân bằng của các chất điều hòa sinh trưởng trong môi trường có ảnh hưởng điều khiển tới quá trình phát sinh hình thái. Các nghiên cứu trước đây đã đồng ý rằng sự điều tiết nồng độ của auxin và cytokinin ngoại sinh đóng vai trò quan trọng đối với sự khởi phát chồi và ảnh hưởng mạnh mẽ đến sự phát sinh hình thái trong nuôi cấy mô (Rout và cộng sự, 2000). Hơn 90% chồi nhanh chóng ra rễ khi được chuyển sang môi trường MS không có hormone và sau 45 ngày có thể đem trồng ra đất.
Kết luận
Quy trình được đưa ra trong nghiên cứu này có thể sử dụng trong các nghiên cứu sau này để phát triển quy trình nhân giống in vitro chi Ocimum. Những điều này cho phép phát triển quy trình chuyển gen để giải quyết các vấn đề liên quan đến kháng bệnh và kháng sâu hại, đồng thời cũng khởi đầu cho sự lựa chọn sinh hóa, tập trung vào sản xuất các hợp chất thứ cấp. Luciana Bicca Dode1*, Vera Lucia Bobrowski2, Eugenia Jacira Bolacel Braga3, Fabiana Kömmling Seixas 3 và Márcia Wulff Schuch3
1Escola de Educação, Universidade Católica de Pelotas, Rua Felix da Cunha, 412, Caixa Postal 402, 96010-000, Pelotas, Rio Grvàe do Sul, Brasil. 2Departamento de Zoologia e Genética, Instituto de Biologia, Universidade Federal de Pelotas,Caixa Postal 354, campus universitário, s/n, 96010-970, Pelotas, Rio Grvàe do Sul, Brasil. 3Laboratório de Cultura de Tecidos Vegetais, Instituto de Biologia, Universidade Federal de Pelotas, Pelotas, Rio Grvàe do Sul, Brasil.
*Tác giả liên hệ. e-mail: luciana@ufpel.tche.br
TÀI LIỆU THAM KHẢO
AHUJA, A. et al. Clonal propagation of Ocimum species by tissue culture. Indian J. Exp. Biol., New Delhi, v. 20, p. 455-458, 1982.
BEGUN, F. et al. In vitro clonal propagation of holy basil (Ocimum sanctum L.). Plant Tissue Cult., Rehovot, v. 10, n. 1, p. 31-37, 2000.
BEGUN, F. et al. In vitro rapid clonal propagation of Ocimum basilicum. Plant Tissue Culture, Rehovot, v. 12, n. 1, p. 27-35, 2002.
KHANNA, H.K.; RAINA, S.K. Genotype x culture media interaction effects on regeneration response of three indica rice cultivars. Plant Cell, Tissue Organ. Cult., Dordrecht, v. 52, p. 145- 153, 1998.
MURASHIGE, T.; SKOOG, F. A revised medium for rapid growth and bioassays with tabacco tissue cultures. Physiol. Plant, Compenhagem, v. 15, p. 473-479, 1962.
PATTANAIK, S.; CHAND, P.K. In vitro propagation of the medicinal herbs Ocimum americanum L. syn. O. canum Sims. (hoary basil) and Ocimum sanctum L. (holy basil). Plant Cell Repo, Berlin, v. 15, p. 846-850, 1996.
PHIPPEN, W.B.; SIMON, J.E. Anthocyanins in basil. J. Agric. Food Chem., Washington, DC., v. 46, p. 1734-1738, 1998.
PHIPPEN, W.B.; SIMON, J.E. Shoot regeneration of young leaf explants from basil (Ocimum basilicum L.), In Vitro Cell. Dev. Biol. Plant, Largo, v. 36, p. 250-254, 2000.
ROUT,G.R. et al. In vitro manipulation and propagation of medicinal plants. Biotechnology Advances, v. 18, p. 91-120, 2000.
SAHOO, Y. et al. In vitro clonal propagation of an aromatic medicinal herb Ocimum basilicum L. (sweet basil) by axillary shoot proliferation. In Vitro Cell. Devel. Biol. Plant, Largo, v. 33, p. 293-296, 1997.
SHARZAD, A.; SIDDIQUI, S.A. In vitro organogenesis in Ocimum sanctum L. – A multipurpose heb. Phytomorphology, Delhi, v. 50, n. 1, p. 27-35, 2000.
SHETTY, K. Biotechnology to harmess the benefits of dietary phenols: focus on Lamiaceae. Asia Pacific J. Clin. Nutr., v. 6, n. 3, p. 162-171,1997.
SINGH, N.K.; SEHGAL, C.B. Micropropagation of “Holy basil” (Ocimum sanctum L.) from young inflorescens of mature plants. Plant Growth Regul., Dordrecht, v. 29, p. 161-166, 1999.
VIEIRA, R.F. et al. Genetic diversity of Ocimum gratissimum L. based on volatile oil constituents, flavonoids and RAPD markers. Biochem. Syst. Ecol., Kidlington, v. 29, n. 3, p. 287-304, 2001.
ZONTA, E.P.; MACHADO, A.A. SANEST: Sistema de análise estatística para computador. Registered at Secretaria Especial de Informática (SEI), no. 066-060 – category A, Pelotas, 1984
Nhận bài: 10/2/2002
Chấp nhận đăng: 19/3/2003
Khải Mùi


































































































































































































































































































